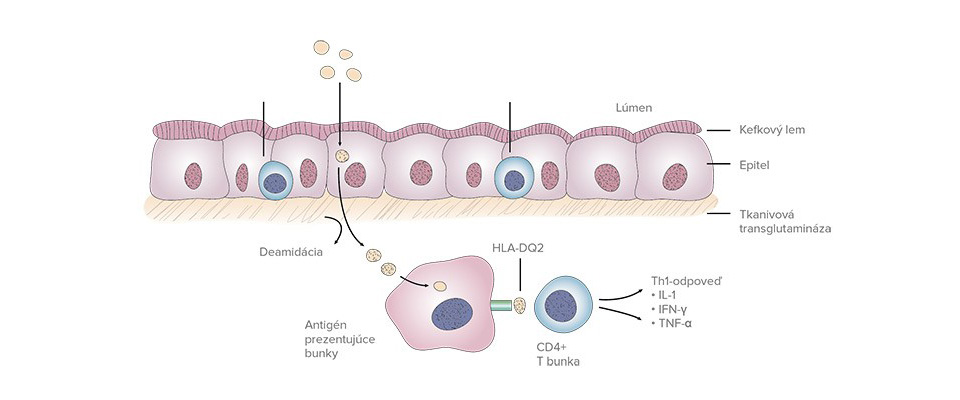
Celiakia je multigénne chronické zápalové ochorenie, ktoré sa vyskytuje u geneticky predisponovaných jedincov po príjme gluténu a je charakterizované chronickým zápalom tenkého čreva, ktoré vedie k vilóznej atrofii. Ochorenie postihuje dvakrát častejšie ženy ako mužov, je vzácne u africkej, japonskej a čínskej populácie.
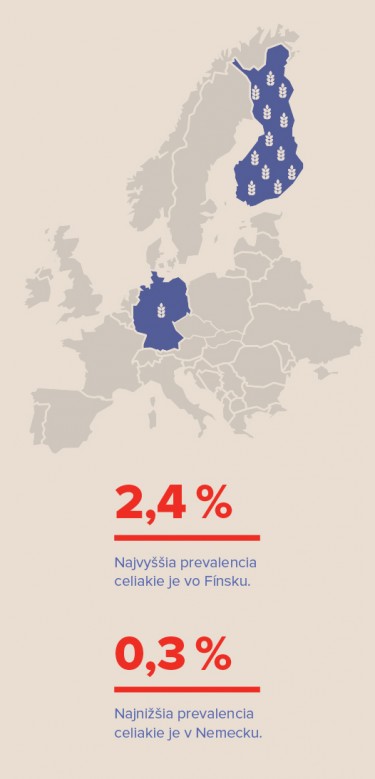
Prevalencia klinicky diagnostikovaného ochorenia v Európe u je 0,33 – 1,06 % u detí a 0,18 – 1,2 % u dospelých. Najvyššia prevalencia je vo Fínsku (2,4 %) a najnižšia v Nemecku (0,3 %). U prvostupňových a druhostupňových príbuzných je prevalencia 3,0 – 15 %, u pacientov s Downovým syndrómom, Turnerovým syndrómom, diabetom 1. typu, autoimunitnou tyreoiditídou a lymfocytovou kolitídou je prevalencia celiakie 5 – 10 %, hoci niektorí autori uvádzajú až 27 %.
Pre celiakiu sú charakteristické:
- rôzne kombinácie glutén-dependentnej klinickej manifestácie,
- špecifické protilátky (protilátky proti tkanivovej transglutamináze – anti-TTG, protilátky proti endomýziu – EMA a protilátky proti deaminovaným gliadinovým peptidom – DGP),
- HLA–DQ2/HLA-DQ8 haplotypy,
- enteropatia.

Patogenéza
1. ENVIRONMENTÁLNA
Aj keď environmentálne faktory ešte nie sú úplne prebádané, predpokladá sa, že okrem gluténu môžu byť spúšťačom ochorenia vírusy (adenovírus 12), parazity, stres, pôrod, prekonanie infekčnej enteritídy.
Základnými zdrojmi gluténu sú obilniny – pšenica, raž a jačmeň. Posledné poznatky ovos ako zdroj gluténu odmietajú, hoci v diéte sa jeho vylúčenie zatiaľ odporúča.
2. GENETICKÁ
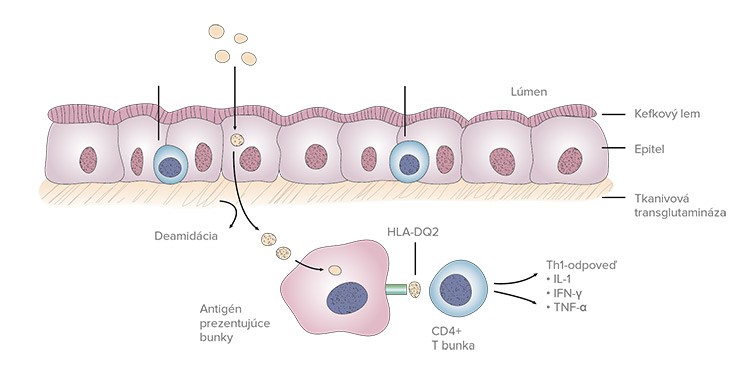
Hlavnou genetickou predispozíciou sú určité varianty alely HLA, hlavného histokompatibilného systému človeka. Pre celiakiu sú diagnosticky významné HLA molekuly II. triedy, ktoré sú lokalizované na krátkom ramene 6. chromozómu. Prevažná väčšina pacientov s celiakiou (až 95 %) má vo svojom genotype HLA-DQ2 heterodimér v konfigurácii cis (častejšie v centrálnej a severnej Európe) kódovaný HLA-DR3-DQA1*05:01-DQB1*02:01 alebo trans (častejšie v krajinách Stredomoria) kódovaný HLA-DR11-DQA1*05:05-DQB1*03:01/DR7-DQA1*02:01-DQB1*02:02, zvyšná časť pacientov (najmä u pôvodných obyvateľov južnej Ameriky) vykazuje prítomnosť HLA-DQ8 heterodiméru kódovaného DQA1*03:01-DQB1*03:02.
Počet pacientov s celiakiou, ktorí nie sú nositeľmi DQ2 alebo DQ8, je 0,4 %. Napriek tomu, že až 25 – 30 % zdravej populácie je nositeľom týchto heterodimérov v porovnaní s 95 % chorých na celiakiu, ich prítomnosť významne zvyšuje možnosť manifestácie celiakie.
V súčasnosti je známych ďalších 27 geneticky rizikových lokusov s miernym rizikom vývoja celiakie, sú však známe aj protektívne genetické lokusy (napr. IL12A, CCR1, CCR2, CCR3, CCR5, LPP, SH2B3, IL18R1, IL18RAP, TAGAP a CTLA4).
3. IMUNOLOGICKÁ
Celiakia nie je potravinová alergia, ale je to zápalové ochorenie podmienené prítomnosťou gluténu v prijímanej potrave. Rôzne peptidy gluténu sú zapojené do chorobného procesu odlišným spôsobom, niektoré fragmenty sú toxické, iné imunogénne. Rovnaký peptid však môže mať obe vlastnosti.
 Klinický obraz a diagnostika
Klinický obraz a diagnostika
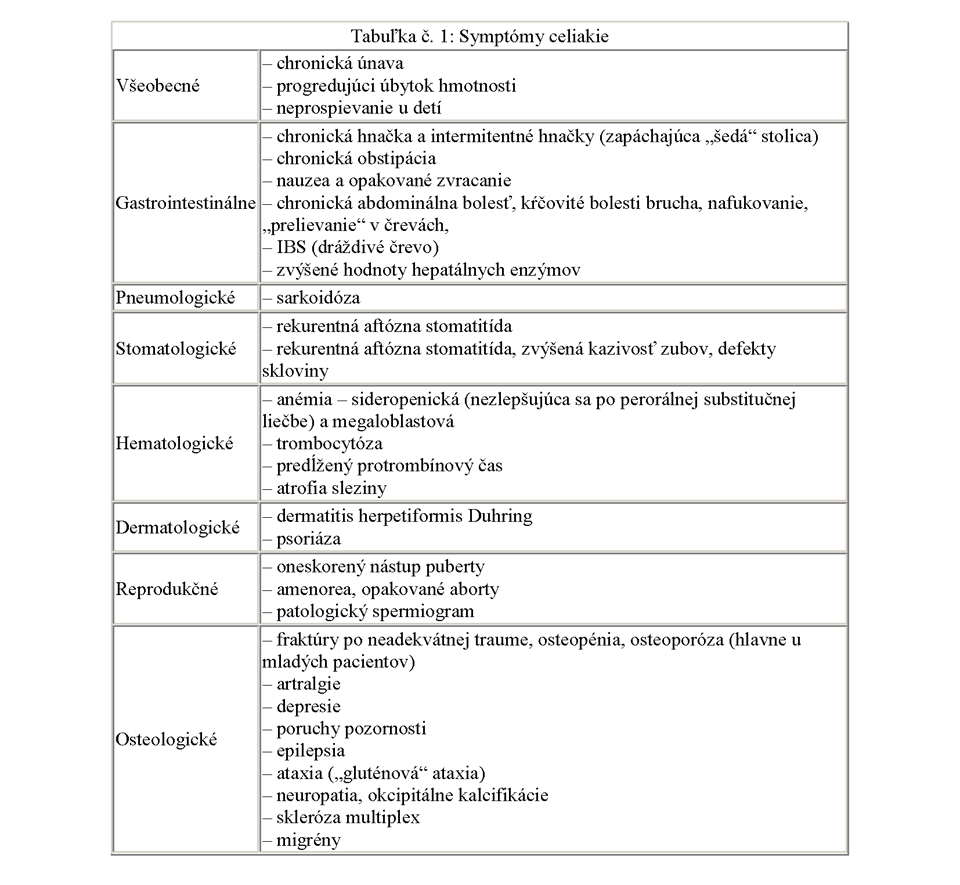
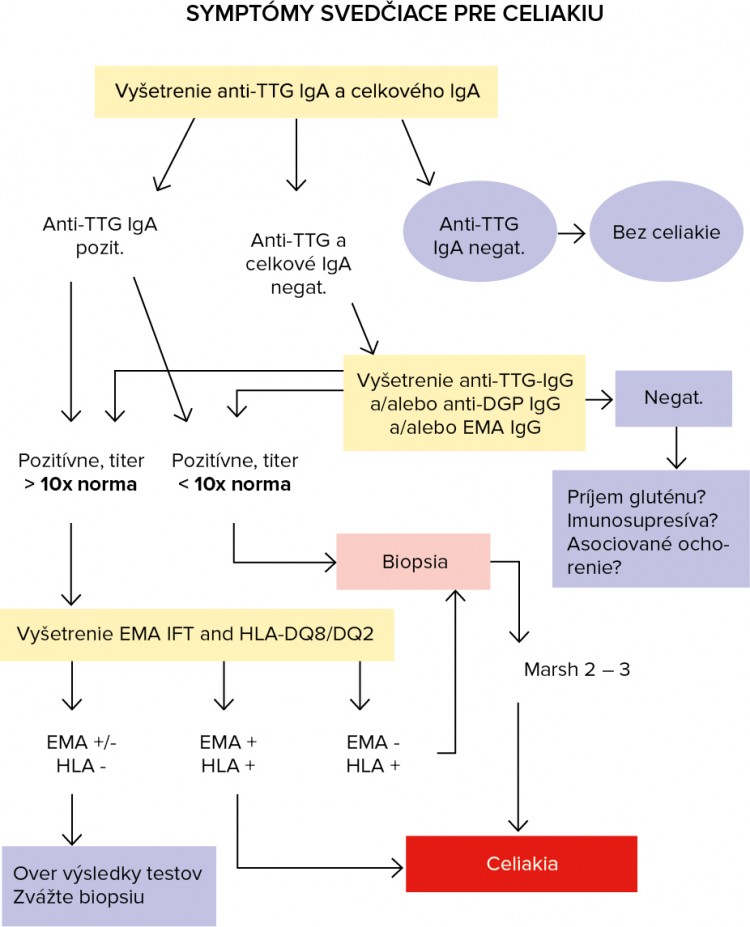
Celiakia bola v minulosti chorobou detí s typickými príznakmi, avšak dnes tvoria najväčšiu skupinu novodiagnostikovaní pacienti medzi 45. – 65. rokom. Jej klinický obraz závisí od stupňa histologických zmien na tenkom čreve, od výživy (hlavne od príjmu gluténu v potrave) a od veku. Napriek výraznému pokroku v diagnostike sa v súčasnosti stále predpokladá, že ochorenie je poddiagnostikované. Vzhľadom na rôznorodosť symptómov by mali byť vyšetrené deti aj dospelí, u ktorých sa vyskytujú symptómy uvedené v Tabuľke č. 1.
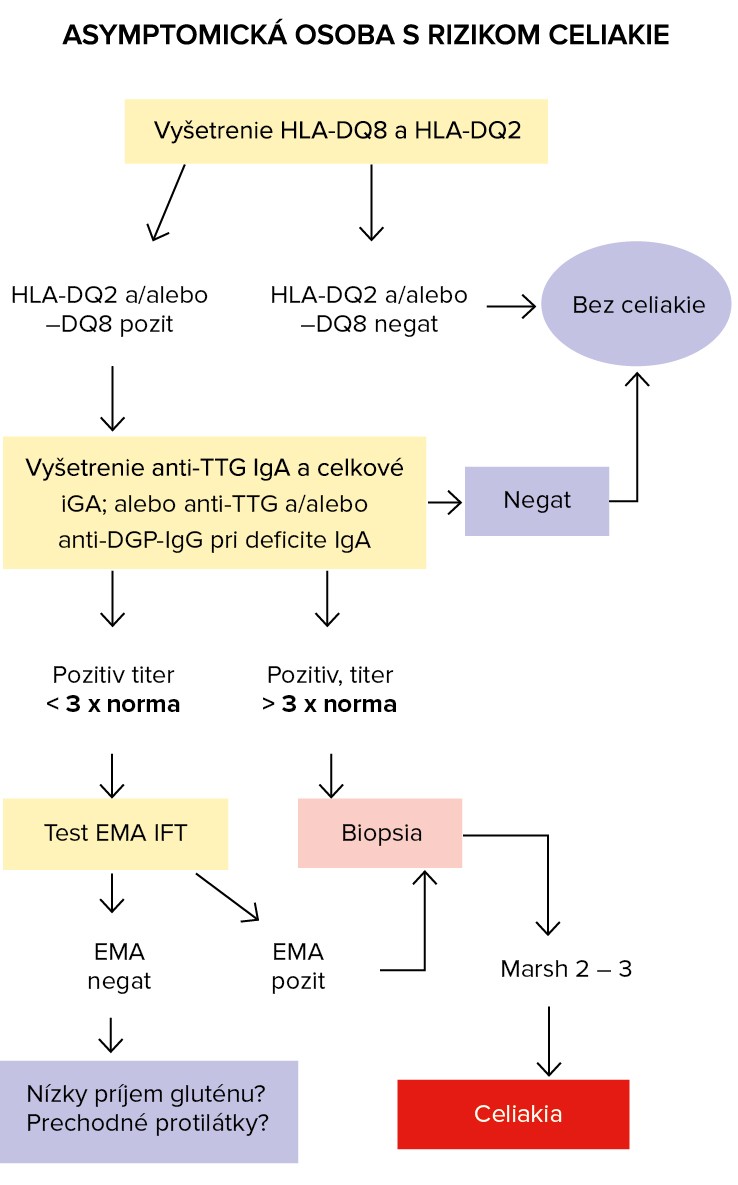
Vyšetrené by mali byť aj asymptomatické deti a dospelí s rizikom celiakie pri diagnostikovaní nasledujúcich ochorení (tzv. ochorenia asociované s celiakiou):
- diabetes mellitus 1. typu,
- Downov syndróm,
- Turnerov syndróm,
- Williamsov-Beurenov syndróm,
- selektívny deficit imunoglobulínu A (IgA),
- IgA nefropatia u dospelých,
- Addisonova choroba,
- autoimunitné ochorenia pečene,
- juvenilná chronická artritída,
- artritídy u dospelých,
- Sjögrenov syndróm,
- autoimunitná tyreoiditída,
- idiopatická dilatačná kardiomyopatia,
- prvostupňoví príbuzní.
Rozdelenie podľa klinickej manifestácie:
- klinická (symptomatická) celiakia – pacient má klinické príznaky, pozitívne autoprotilátky, histologicky potvrdené zmeny na sliznici,
- tichá (silentná) celiakia – pacient nemá klinické príznaky, histologický nález je rovnaký ako pri klinickej celiakii, v krvi sú prítomné pozitívne autoprotilátky,
- latentná celiakia – pacient má klinické príznaky, histologicky prítomné zvýšené nahromadenie intraepiteliálnych lymfocytov (IEL), prítomné sú pozitívne autoprotilátky v krvi,
- potenciálna celiakia – pacient nemá klinické príznaky, má však ochorenie asociované s celiakiou; histologicky len zvýšený počet IEL, môže mať pozitívne autoprotilátky v krvi.
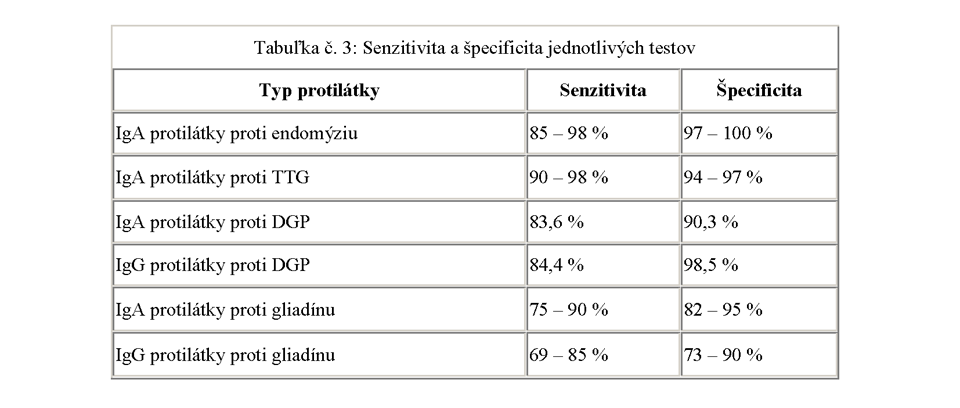
Najlepšou kombináciou na skríning celiakie je vyšetrenie IgA protilátky proti TTG + IgG protilátky proti DGP. Je však vhodné aj ponechanie vyšetrenia IgG protilátok proti gliadínu hlavne u detí do 2 rokov, keďže hladina IgA protilátok proti TTG a IgA protilátok proti gliadínu má v tomto období života veľmi fluktuujúci charakter.

Odporúčaná frekvencia vyšetrovania protilátok
Protilátky v krvi by pri stanovenej diagnóze celiakie mali byť vyšetrované po nasadení diéty nasledovne: po prvom mesiaci, po troch, šiestich a dvanástich mesiacoch ako kontrola účinnosti (a dodržiavania) diétnych opatrení a potom pravidelne raz ročne.
Pri prísnej diéte by mali byť hodnoty všetkých vyšetrovaných protilátok v krvi negatívne, časové súvislosti sú však veľmi individuálne. Mierne a krátkodobé expozície antigénom nemusia viesť k objaveniu sa cirkulujúcich protilátok v krvi.
Nové potenciálne užitočné skupiny autoprotilátok:
- anticalretikulínové protilátky – monitorovanie v triede IgA by mohlo mať význam u refraktérnej celiakie (zvýšené hladiny anti-CR IgA zistnené aj pri prísnej bezlepkovej diéte a negativite AGA, anti-TTG a často aj EMA); zistené u viacerých chorôb (SLE, autoimúnna tyreoiditída),
- antizonulínové protilátky (AZP) – nájdená zvýšená hladina u celiatikov, (predpokladá sa zvýšená priepustnosť medzibunkových spojení v GIT-e a následná zvýšená priestupnosť gluténu do organizmu),
- antigelsolínové protilátky.
Genetické testy (imunogenetické znaky – HLA antigény)
Genotypizácia haplotypov DQ2/DQ8 významne prispieva k zložitej diagnostike celiakie. Podľa guideline EPSGHAN (2012) je súčasťou diagnostických algoritmov a jej význam spočíva:
- vo vysokej negatívnej prediktívnej hodnote v prípadoch diagnostických pochybností,
- v prípadoch s vysokou suspekciou pre celiakiu, s vysokými hladinami anti-TTG (> 10 x norma) a pozitivitou HLA-DQ2/DQ8 – nie je nutná duodenálna biopsia pre stanovenie diagnózy celiakie.
Interpretácia výsledkov genetických testov:
- ak sú u symptomatického pacienta neprítomné alely HLA-DQA*05,HLA-DQB*02 a HLA-DQB*03:02, celiakiu môžeme vylúčiť,
- ak sú u symptomatického pacienta prítomné obe alely (HLA-DQA*05 aj HLA-DQB*02), manifestácia celiakie je vysoko pravdepodobná, ale je potrebné doplniť vyšetrenie protilátok a biopsiu z tenkého čreva,
- ak je u symptomatického pacienta prítomná alela HLA-DQB*03:02, manifestácia celiakie je pravdepodobná, ale je potrebné doplniť vyšetrenie protilátok a biopsiu z tenkého čreva,
- prítomnosť iba HLA-DQ2 heterodiméru (HLA-DQA*05 alebo HLA-DQB*02) má pre diagnózu celiakie nízku výpovednú hodnotu.
Histológia
Histologické a histochemické vyšetrenie vzorky odobratej z tenkého čreva zostáva zlatým štandardom pre definitívnu diagnózu celiakie. Biopsia sa má robiť vždy po zhodnotení výsledkov biochemických a imunologických vyšetrení, pokiaľ pacient ešte nedodržiava bezlepkovú diétu.
Od histológie môžeme upustiť, ak pacient spĺňa 3 kritériá:
- má typické či atypické klinické symptómy,
- má 10-násobne zvýšené anti-TTG IgA, EMA pozitívne,
- je HLA-DQ2 a/alebo HLA-DQ8 heterodimér pozitívny.
Vo väčšine prípadov stačí odber z hlbokej duodenoskopie (aborálne od Vaterovej papily), ktorý sa môže urobiť počas bežného gastrofibroskopického vyšetrenia. Dôsledné vyšetrenie však spočíva v odobratí 6 vzoriek z distálneho duodena.
Fyziologicky je vilózno-kryptový index 4 – 5 : 1. Nález malého množstva intaepitelových lymfocytov, hlavne na báze krýpt, je normálnym nálezom. Názory na hraničné hodnoty intraepitelových lymfocytov sa menili, v súčasnosti sa za signifikantnú intraepitelovú lymfocytózu uznáva 25 lymfocytov na 100 enterocytov.
Histologická klasifikácia celiakie (vypracoval Marsh, následne ju modifikoval Oberhuber):
- kategória 0: normálny nález a je rezervovaná pre dokázanú celiakiu pri bezlepkovej diéte,
- typ 1 (infiltratívny typ): neporušená architektúra sliznice a signifikantná intraepitelová lymfocytóza; na rozdiel od iných príčin možno pri celiakii pozorovať akcentáciu intraepitelových lymfocytov smerom k vrcholom klkov,
- typ 2 (hyperplastický typ): predlžujú sa krypty, bez zreteľného skracovania klkov; tento typ je veľmi zriedkavý,
- typ 3 (deštruktívny typ): podľa stupňa atrofie delíme na tri kategórie:
- A – parciálnu atrofiu,
- B – subtotálnu atrofiu,
- C – totálnu atrofiu.
Pôvodná Marshova kategória 4 bola zrušená – išlo prevažne o monoklonovú intraepitelovú proliferáciu lymfocytov, čo už patrí do problematiky non-Hodgkinových malígnych lymfómov.
Pri nekomplikovanej celiakii a pri refraktérnej celiakii 1. typu intraepitelovo prevažujú lymfocyty CD8 nad lymfocytmi CD3, pričom tvoria 50 – 100 % intraepitelových lymfocytov. Pokles CD8 pod 50 % sa považuje za aberantný imunofenotyp, 80 % takýchto prípadov predstavuje monoklonovú proliferáciu, ktorá je riziková, pravdepodobne ide o predstupeň rozvoja enteropatického T-bunkového lymfómu.
Ako sľubná metóda stanovenia vilóznej atrofie sa ukazuje endocytoskopia, ktorá využíva vizualizáciu sliznice tenkého čreva na bunkovej úrovni. Dosahuje senzitivitu 88 % a špecificitu 100 %, a to najmä pri určovaní pokročilejších histologických štádií celiakie.
Za experimentálne možno zatiaľ považovať vyšetrenia využitím kapsulovej enteroskopie a konfokálnej laserovej endomikroskopie.
Pri pokročilej celiakii (refraktérna sprue) je pre prognózu a liečbu rozhodujúca biopsia so stanovením imunofenotypu intraepitelových T-lymfocytov:
- typ 1 bez aberantných intraepiteliálnych T-lymfocytov,
- typ 2 s abnormálnym fenotypom intraepiteliálnych T-lymfocytov – považuje sa za kryptogénny lymfóm a nemá dobrú prognózu.

Ak nedochádza k zlepšeniu klinického stavu a normalizácii autoprotilátok, biopsiu opakujeme!
Doplňujúce vyšetrenia
U refraktérnej sprue je dôležité aktívne pátranie po lymfóme a karcinóme, preto je zatiaľ najvhodnejšou metódou CT/MR enteroklýza.
Liečba
Celiakiu nemožno vyliečiť.
Za jedinú liečbu považujeme dôslednú bezlepkovú diétu (vynechanie lepku z potravy, t. j. vylúčenie pšeničnej, jačmennej, ražnej a aj diskutovanej ovsenej múky z jedálnička). Treba si dávať pozor na najrozličnejšie prísady do potravín, ktoré môžu obsahovať lepok v rámci technologického procesu úpravy potraviny. Za bezpečný sa považuje príjem gluténu v množstve menej ako 10 mg denne. Už po dvoch týždňoch diéty pozoruje väčšina pacientov zlepšenie stavu, no výrazné zlepšenie sa prejaví až po niekoľkých mesiacoch – u mladých ľudí a u starších pacientov dokonca až po 2 – 3 rokoch.
Keďže u pacientov s celiakiou je častá sekundárna laktózová intolerancia a intolerancia mlieka, v rámci liečebnej stratégie je vhodné vynechať na prechodnú dobu (min. 6 týždňov) mlieko a mliečne výrobky a po postupnej reštitúcii sliznice a funkcie kefkového lemu enterocytov väčšina pacientov začne určité množstvo mlieka opätovne tolerovať.
Kedy dodržiavať prísnu bezlepkovú diétu:
- pozit. anti-TTG + pozit. HLA DQ2 a/alebo DQ8 + pozit. DGP,
- negat. anti-TTG + pozit. HLA DQ2 a/alebo DQ8 + pozit. DGP.
Nález doplniť histológiou.
Dôležitá je substitúcia
Kalcium, foláty, železo, vitamín B12, vitamíny A, D, E, K.
Stav bezlepkovej diéty môžu čiastočne ovplyvniť tráviace enzýmy a probiotiká typu:
- Lactobacillus – acidophilus, rhamnosus, reuteri, casei,
- Bifidobacterium – lactis, infantis, longum.
Liečba budúcnosti
- Dietetické modifikácie, ktoré sú považované za bezpečné: niektoré druhy pšenice s veľmi nízkym obsahom alfa a beta gluténu, non-imunogenetické prastaré druhy pšenice, Psyllium ako náhrada gluténu.
- Inhibícia priepustnosti a rekonštrukcie sliznice – Zonulin/ZOT receptorová blokáda.
- Supresia prezentujúceho antigénu – inhibícia tkanivovej transglutaminázy 2.
- Blokáda – HLA DQ2/DQ8.
- Cytokínová a protizápalová terapia – protizápalové zlúčeniny (Budesonid), augmentácia regulačných cytokínov, blokáda zápalových cytokínov (anti-IL-10, anti-IFN-gama, anti-TNF-alfa, anti-IL-15).
- Aktivácia lymfocytov – blokáda adhézie.
- Imunomodulácia, indukcia tolerancie, vakcinácia gluténom, parazitická infekcia (Necator americanus).
- Transplantácia kmeňových buniek.
Komplikácie a následky diagnózy celiakie
Neliečená alebo neskoro diagnostikovaná celiakia (vek nad 50 rokov) je považovaná za prekancerózu! Prevalencia výskytu malignít u pacientov s touto diagnózou sa uvádza v 8 – 10 %. Toto riziko je možné ovplyvniť striktným dodržiavaním bezlepkovej diéty a po 5-ročnom dodržiavaní sa už riziko nelíši od zdravej populácie.
Najčastejšie komplikácie:
- Non-Hodgkinov lymfóm a T-lymfóm vznikajú pravdepodobne v dôsledku oslabenia imunitného systému dlhodobou antigénnou stimuláciou gluténom. T-lymfóm asociovaný s enteritídou je komplikáciou refraktérnej celiakie 2. typu. Pátrať po lymfóme treba vždy, ak dôjde k relapsu ochorenia s úbytkom telesnej hmotnosti, teplotami a bolesťami brucha.
- Adenokarcinóm tenkého čreva.
- Celulárny karcinóm pažeráka.
- Refraktérna sprue – symptomatická ťažká vilózna atrofia tenkého čreva, ktorá sa klinickým obrazom podobá na celiakálnu sprue, ale nereaguje na striktnú bezlepkovú diétu (trvajúcu aspoň 6 mesiacov), pričom stav sa nedá vysvetliť inými príčinami vilóznej atrofie alebo nálezom intestinálneho lymfómu. Komplikácie – lymfóm, ulcerózna jejunoileitída a kolagénová sprue.
- Ulcerózna jejunoileitída.
- Kolagénová sprue.
Záver
Počet novodiagnostikovaných prípadov celiakie naprieč populáciou na celom svete má v posledných rokoch narastajúci trend. Je to aj vďaka kvalitnej laboratórnej diagnostike, ktorá je už dnes aj na Slovensku rutinne dostupná, nevynímajúc portfólio vyšetrení spoločnosti Alpha medical. Mnoho pacientov, hlavne s mimočrevnou klinickou symptomatológiou tohto ochorenia, však ešte stále zostáva dlhodobo nerozpoznaných a je úlohou edukačných aktivít všetkých zainteresovaných odborníkov túto skutočnosť čo najskôr zmeniť v prospech pacientov.
Literatúra:
- Bonamico M, et al. Serologic and genetic markers of celiac disease: a sequential study in the screening of first degree relatives. J Ped Gastro Nutr 2006; 42: 150 – 4
- Celiac Disease, Clinical Gastroenterology, 2014, pp. 27 – 37, Springer Scienece + Bussines Media New York, 2014
- Corazza GR, Villanacci V, Zambelli C, et al. Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease. Clin Gastroenterol Hepatol 2007; 5: 838 – 43
- ESPGHAN Guidlines fo Diagnosis of Coeliac Disease, JPGN, Volume 54, Number 1, January 2012
- Green PH. The many faces of celiac disease: clinical presentation of celiac disease in the adult population. Gastro 2005; 128:S74–8
- Mothes T. Deamidated gliadin peptides as targets for celiac diseasespecific antibodies. Adv Clin Chem 2007; 44: 35–63
- Sollid LM, Lie BA. Celiac disease genetics: current concepts and practical applications. Clin Gastro Hepatol 2005; 3:843 – 51
zdroj: http://www.alphamedical.sk